8.Sınıf 4.Ünite Kimyasal Tepkimeler Konu Özeti
KİMYASAL TEPKİMELER
KİMYASAL TEPKİME NEDİR?
Farklı maddelerin birbirleriyle etkileşmesi sonucu kendi özelliklerini kaybederek yeni maddelere dönüşmesidir. Bu etkileşim ile maddeyi oluşturan atomlar değişmez. Bu atomlar arasındaki bağlar koparak farklı atomlar arasında yeni bağlar oluşur. Bu şekilde madde kendi özelliklerini kaybederek yeni maddelere dönüşür. Kimyasal tepkimeler denklem ile gösterilir.
KİMYASAL TEPKİME DENKLEMİ
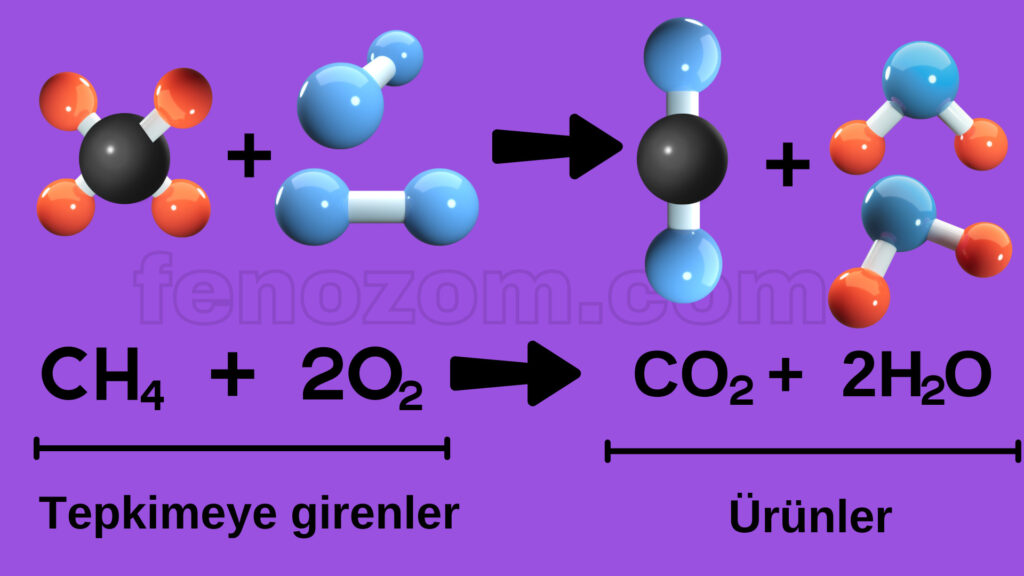
- Kimyasal tepkimelerde girenler kısmında bağ kırılımı, ürünler kısmında bağ oluşumu söz konusudur.
- Tepkimede ok işaretinin yönü tepkimenin gerçekleşme yönünü gösterir.
- Tepkime devam ederken girenler kısmındaki madde miktarı azalırken, ürünler kısmında yeni oluşan maddelerin miktarı tepkime bitene kadar artmaya devam eder.
KİMYASAL TEPKİMELERDE KORUNAN VE DEĞİŞEN ÖZELLİKLER
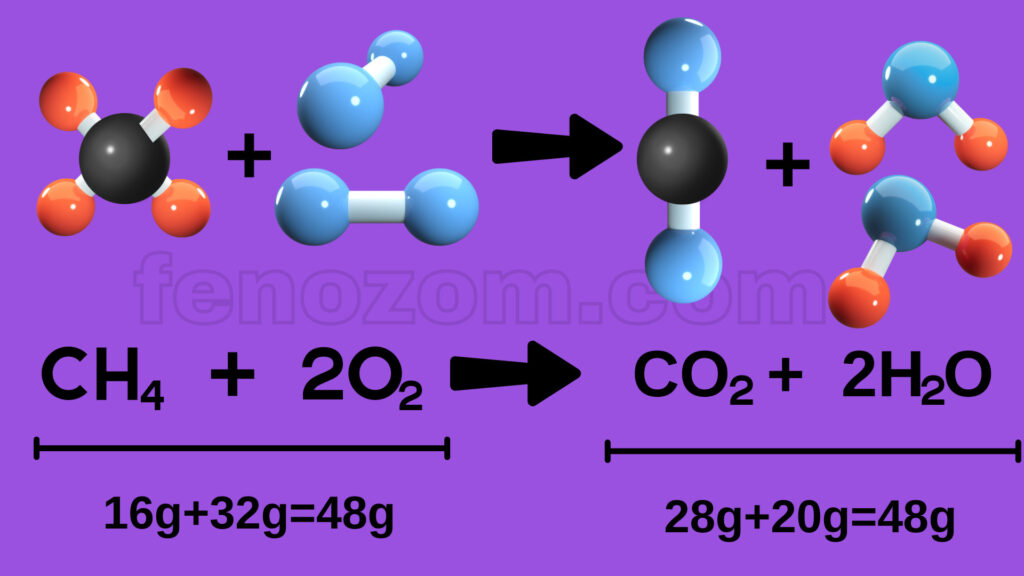
1- Kimyasal tepkimelerde atom sayısı her zaman korunur. Girenler kısmında bulunan toplam atom sayısı ile ürünlerde bulunan toplam atom sayısı her zaman eşittir.
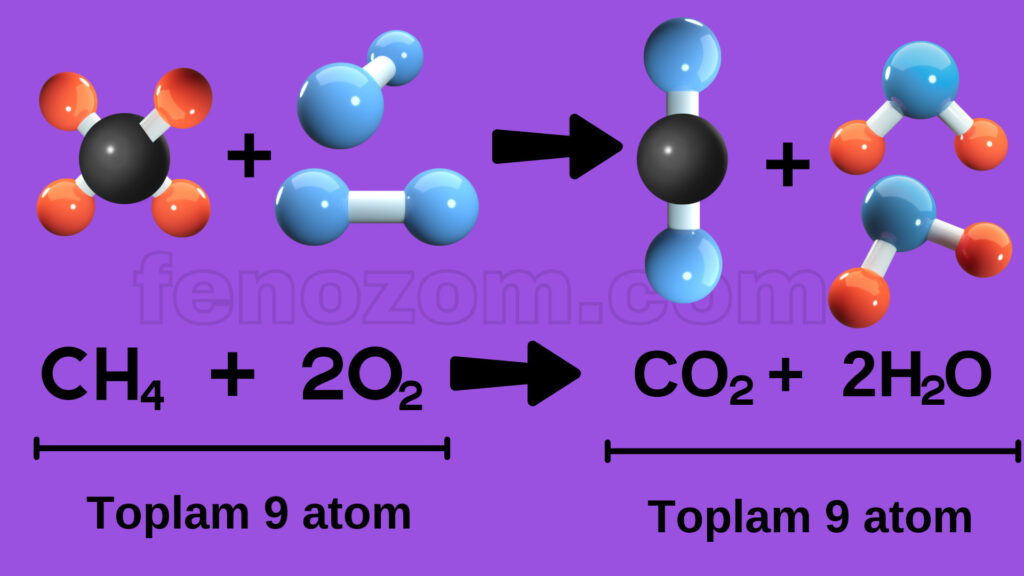
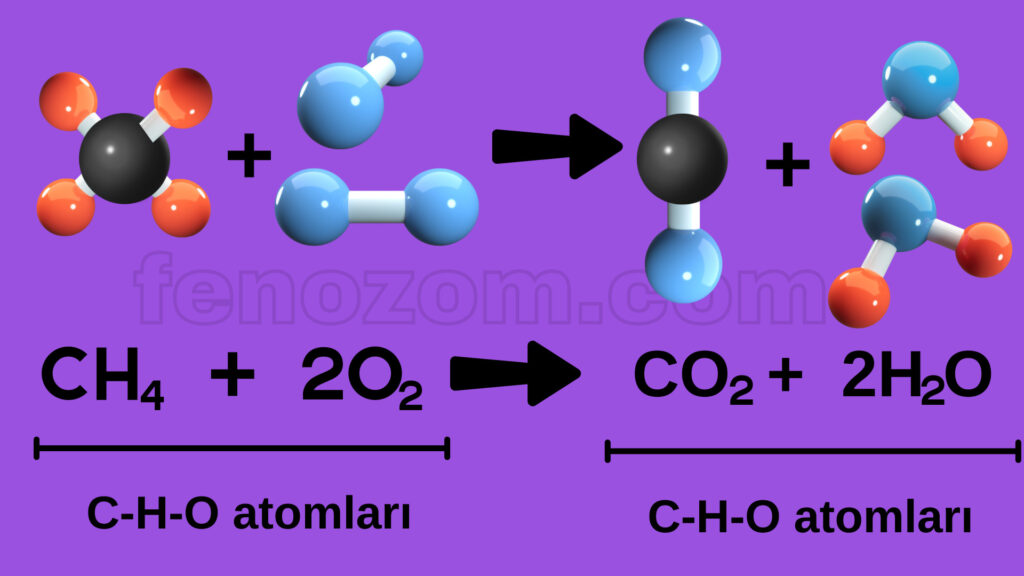
2- Kimyasal tepkimelerde atom cinsi korunur. Tepkimeye hangi atomlar girmişse ürünlerde de bu atomlardan oluşan maddeler bulunur.
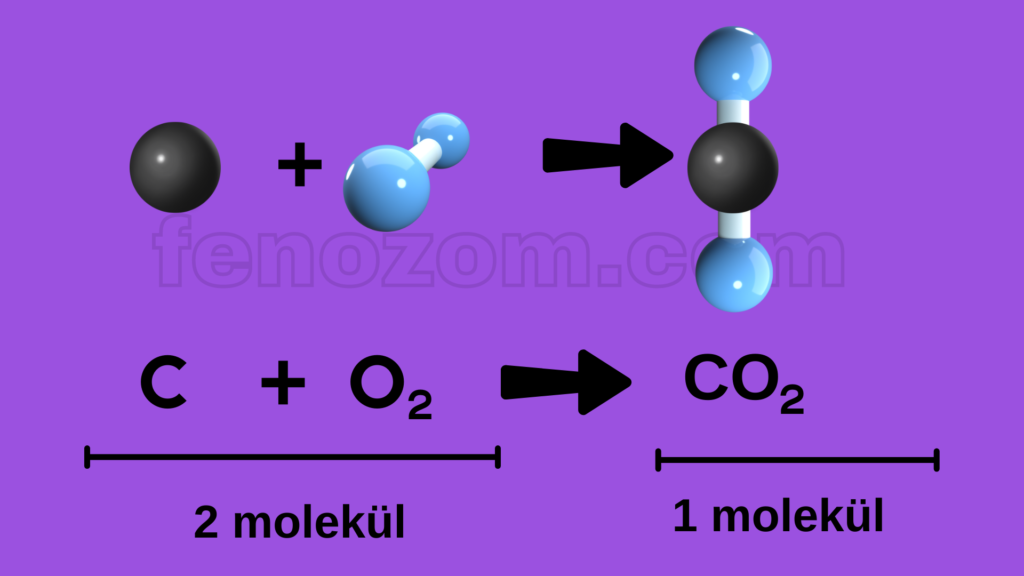
3- Kimyasal tepkimelerde molekül sayısı her zaman korunmayabilir. Atomlar farklı sayıda yeni moleküller oluşturabilir. Molekül çeşidi korunmaz.
4- Kimyasal tepkimelerde kütle her zaman korunur. Tepkimeye girenlerin kütleleri toplamı ürünlerin kütleleri toplamına eşittir.
KİMYASAL TEPKİMELERDE NELER GÖZLENEBİLİR?
RENK DEĞİŞİMİ
Tepkime esnasında maddenin rengi değişebilir.

KOKU DEĞİŞİMİ
Tepkime esnasında koku değişebilir.

ISI VE ALEV OLUŞUMU
Tepkime esnasında maddenin sıcaklığı artabilir.

GAZ ÇIKIŞI
Tepkime esnasında gaz çıkışı gözlenebilir.

IŞIK OLUŞUMU
Tepkime esnasında ışık oluşumu gözlenebilir.

ÇÖKELTİ OLUŞUMU
Tepkime esnasında dibe katı madde çökebilir.

KİMYASAL TEPKİME KÜTLE GRAFİĞİ
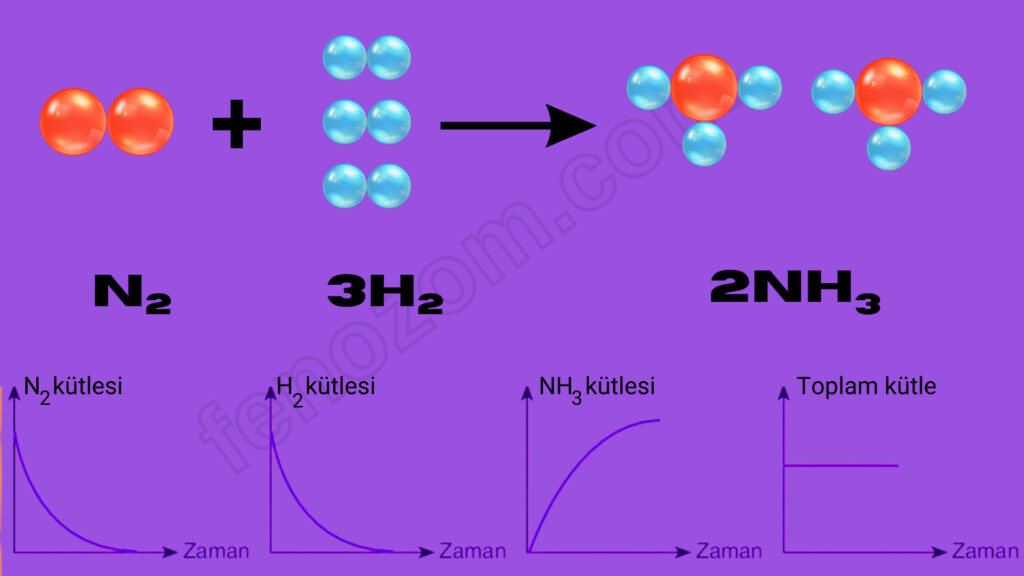
Kimyasal tepkimelerde grafik çizilirken tepkimeye girenlerin miktarı zamanla azalacaktır. Eğer artansız bir tepkime gerçekleşiyorsa grafikte madde miktarı zamanla azalarak sıfır çizgisine iner. Sıfır çizgisine inmeyen grafiklerde o maddenin bir miktarı tepkimeye girmeden artmıştır. Ürünlerde oluşan maddeler ise grafikte sıfırdan başlayarak zamanla miktarı artar. Toplam kütle değişmez.
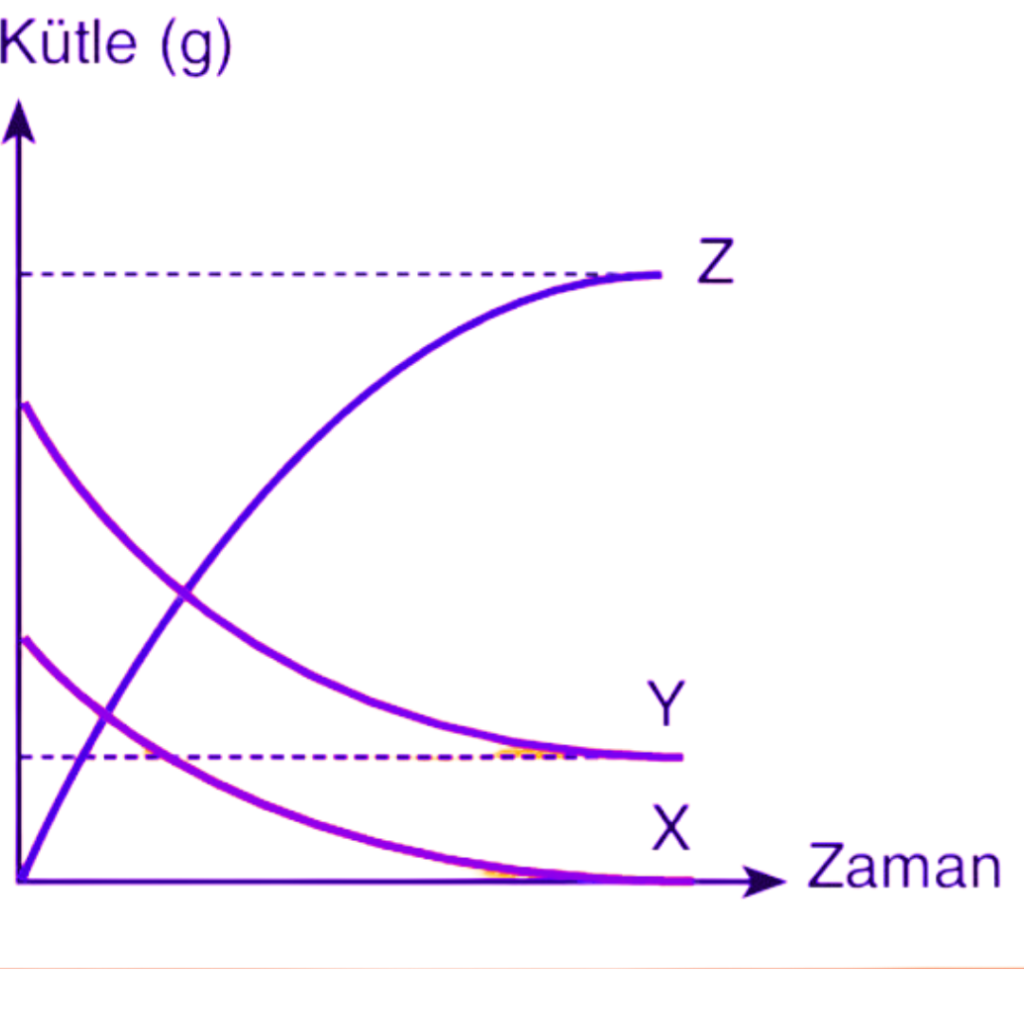
Yandaki grafikte tepkimeye girenler X ve Y iken, Z üründür. X maddesi tepkimede tamamen tükenmiş fakat Y maddesinin bir miktarı artmıştır. Eğer bu tepkimeye X maddesi eklenirse tepkime devam eder.
TEPKİME TÜRLERİ
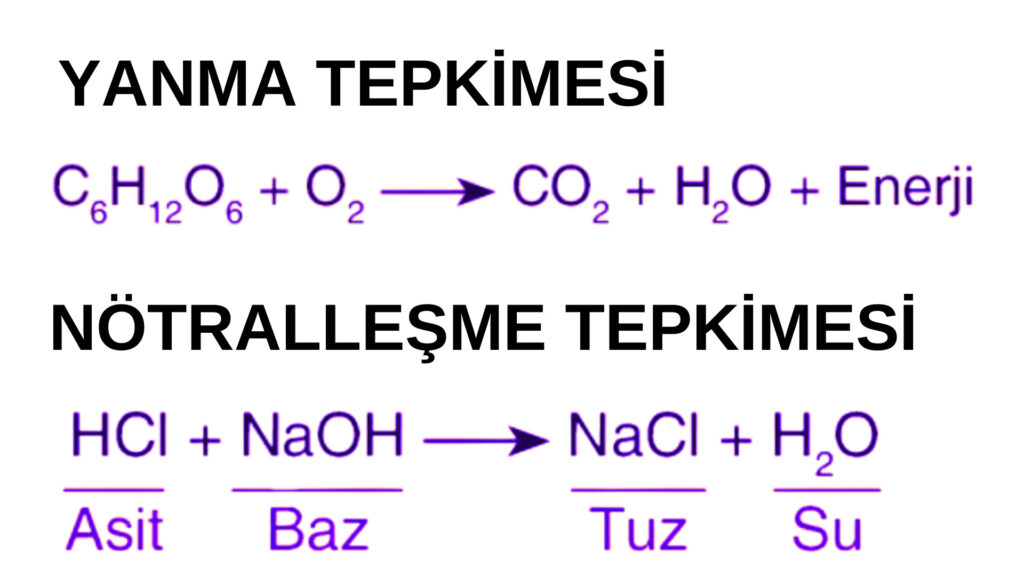
1-YANMA TEPKİMELERİ
Tepkimenin girenler kısmında saf halde Oksijen bulunuyorsa bu tepkime yanma tepkimesidir. Hızlı yanma ve yavaş yanma olmak üzere iki türü vardır. Hızlı yanma tepkimelerinde alev oluşumu söz konusudur. Örneğin kömürün yanması, odunun yanması, kağıdın yanması, metan gazının yanması vb. Yavaş yanma tepkimesi ise paslanma yani oksitlenme tepkimeleridir. Örneğin demirin paslanması
2-ASİT-BAZ(NÖTRALLEŞME) TEPKİMELERİ
Tepkimeye asit ve bazın girmesiyle tuz ve su oluşur. Maddeler asitlik ve bazlık durumlarını kaybederek nötr hale gelirler.
8.Sınıf 4.Ünite Kimyasal Tepkimeler Konu Özeti
Fenozom’u Takip Edin!

