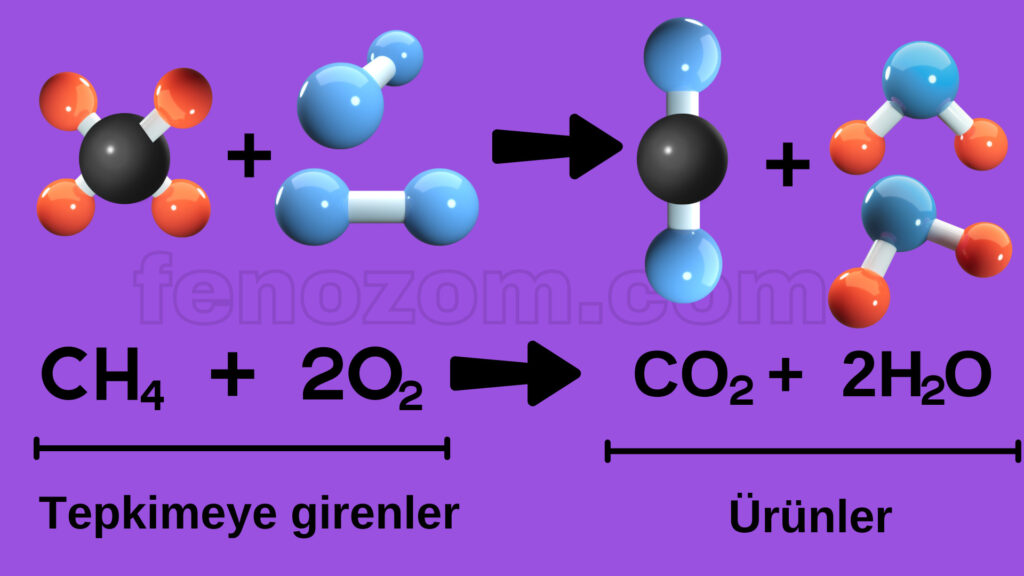
8.Sınıf 4.Ünite Asitler ve Bazlar Konu Özeti
ASİTLER VE BAZLAR
ASİT NEDİR?
Sulu çözeltilerine H+ iyonu veren maddelere asit denir.
ASİTLERİN ÖZELLİKLERİ
- Tatları ekşidir.
- Yakıcı, tahriş edici özelliktedir.
- Sulu çözeltileri elektrik akımını iletir.
- Turnusol kağıdını kırmızı renge boyarlar.
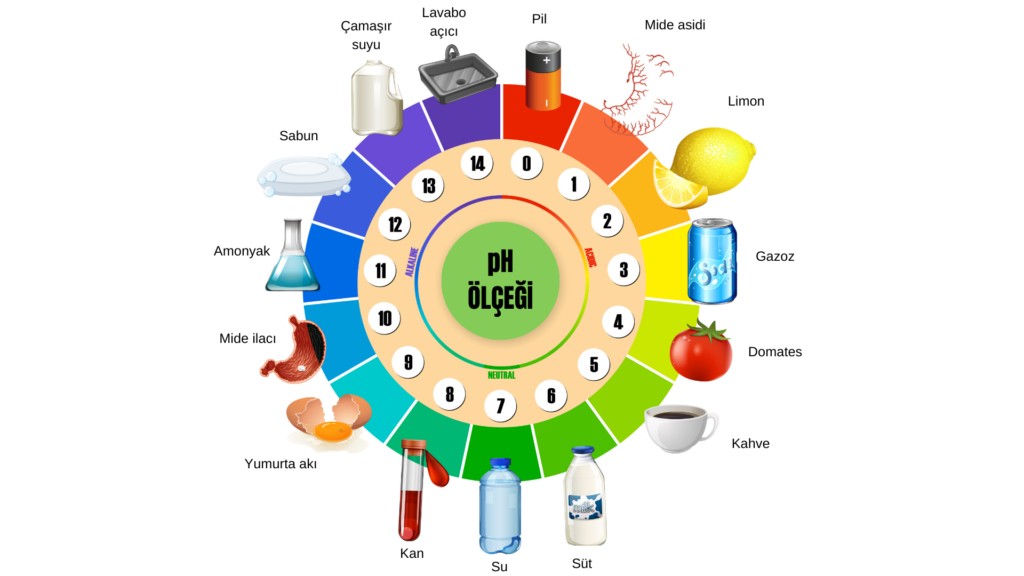
- pH cetvelinde 0-7 arasında yer alırlar.
- Metalleri, kumaşı, deriyi ve mermeri aşındırırlar. Metallerle tepkimeye girerek H2 gazı oluştururlar.
- Bazlarla tepkimeye girerek tuz ve su oluştururlar.
BAZ NEDİR?
Sulu çözeltilerine OH– iyonu veren maddelere baz denir.
BAZLARIN ÖZELLİKLERİ
- Tatları acıdır.
- Ele kayganlık verici özelliktedir.
- Sulu çözeltileri elektrik akımını iletir.
- Turnusol kağıdını mavi renge boyarlar.
- pH cetvelinde 7-14 arasında yer alırlar.
- Cam ve porseleni aşındırırlar.
- Asitlerle tepkimeye girerek tuz ve su oluştururlar.
YAYGIN OLARAK KULLANILAN ASİTLER
| ASİTİN FORMÜLÜ | ASİTİN ADI | ASİTİN PİYASA ADI |
| HCl | Hidroklorik asit | Tuz ruhu |
| H2SO4 | Sülfürik asit | Zaç yağı |
| HNO3 | Nitrik asit | Kezzap |
YAYGIN OLARAK KULLANILAN BAZLAR
| BAZIN FORMÜLÜ | BAZIN ADI | BAZIN PİYASA ADI |
| NaOH | Sodyum hidroksit | Sud-kostik |
| KOH | Potasyum hidroksit | Potas-kostik |
| Ca(OH)2 | Kalsiyum hidroksit | Sönmüş kireç |
| NH3 | Amonyak | Amonyak |
GÜNLÜK HAYATTA ASİTLER

GÜNLÜK HAYATTA BAZLAR

pH KAVRAMI VE pH ÖLÇEĞİ
pH( power of Hyrogen)

ASİT BAZ BELİRTEÇLERİ(İNDİKATÖRLER)
| İNDİKATÖR(BELİRTEÇ) | ASİT | BAZ |
|---|---|---|
| TURNUSOL KAĞIDI | KIRMIZI | MAVİ |
| FENOLFTALEİN | RENKSİZ | PEMBE |
| METİL ORANJ | KIRMIZI | SARI |
| MOR LAHANA | KIRMIZI-PEMBE | SARI-YEŞİL-MAVİ-MOR |
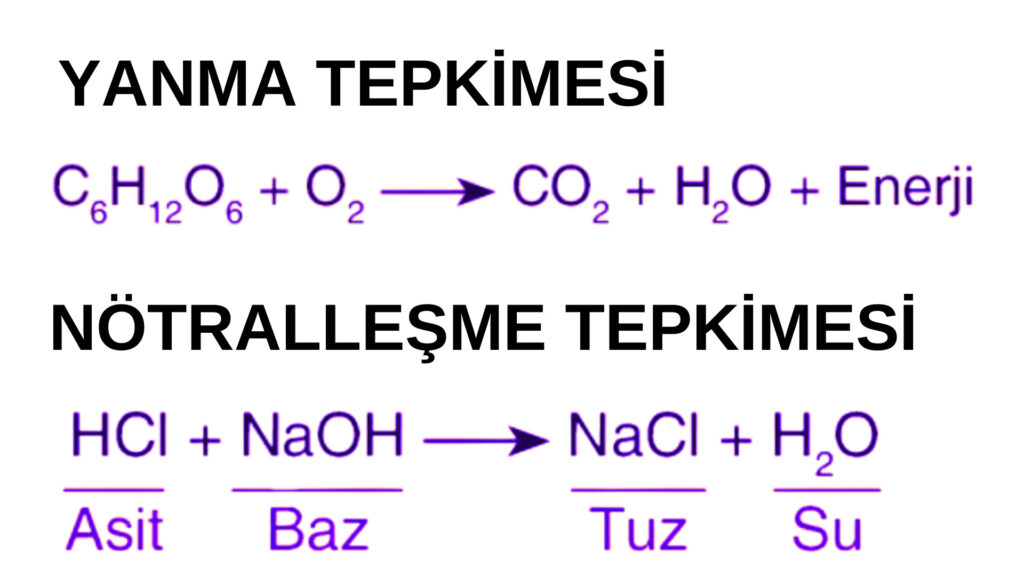
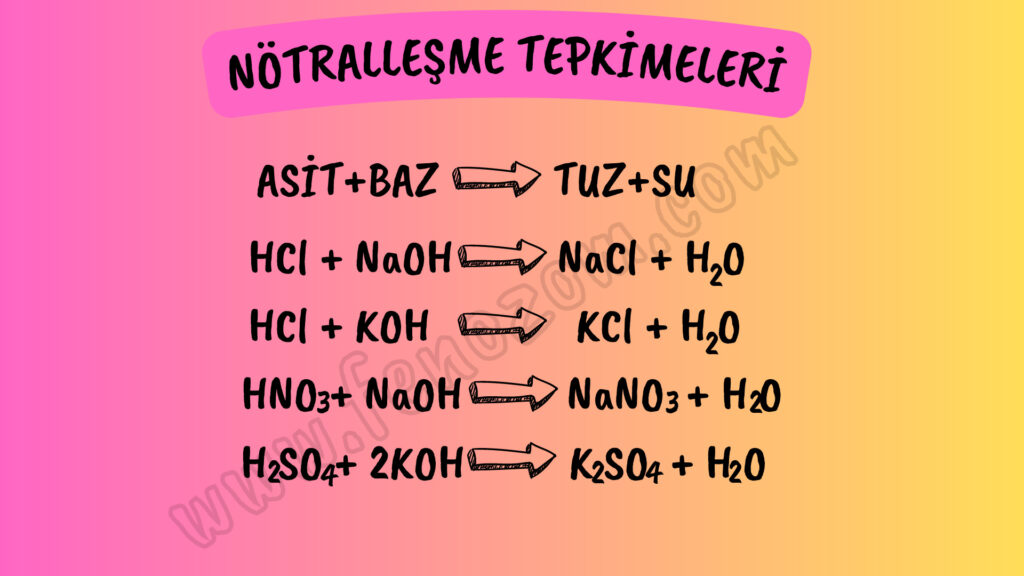
ASİT BAZ ( NÖTRALLEŞME) TEPKİMELERİ
Bir asit ile baz tepkimeye girdiğinde tuz ve su oluşur. Bu şekilde tepkimedeki ürünler nötr hale geçer. Bu sebeple asit baz tepkimelerine nötralleşme tepkimeleri denir. Tepkimeye giren asit ve bazın kuvveti aynı ise tepkime sonucu oluşan ürünler nötr olur. Fakat asidin kuvveti fazla ise sonuçta asidik tuz veya bazın kuvveti fazla ise sonuçta bazik tuz oluşabilir.
ASİT YAĞMURLARI
Atmosferde çok fazla biriken karbondioksit(CO2), azot dioksit( NO2) ve kükürt dioksit( SO2) gibi gazlar atmosferin üst katmanlarında havadaki su buharı ile birleşerek karbonik asit, nitrik asit ve sülfürik asit şekline dönüşür. Bu şekilde yağan yağmurun pH değeri de 5,6’dan küçük olur ve asit yağmuru şeklinde yağar. Kar, dolu şeklinde de yağabilir.

ASİT YAĞMURLARININ ZARARLARI
- Hem canlı hem de cansız varlıklara zarar verir.
- Toprağın pH dengesini bozar.
- Ormanlara zarar verir.
- Tarihi yapılara ve binalara zarar verir.
- Arabaların metal yüzeylerine zarar verir.
- Suyun pH değerini düşürerek sucul canlılara zarar verir.
- İnsanlarda cilt kanserine sebep olabilir.
8.Sınıf 4.Ünite Asitler ve Bazlar Konu Özeti
Fenozom’u Takip Edin!