8.Sınıf 4.Ünite Periyodik Sistem Konu Özeti
PERİYODİK SİSTEM
PERİYODİK SİSTEM NEDİR?
Bilinen 118 elementin kullanılmasını ve öğrenilmesini kolaylaştırmak amacıyla elementlerin belirli bir düzende gruplandırıldığı tablodur. Elementlerin periyodik olarak tekrarlanan özelliklerine göre sıralanmasından dolayı periyodik tablo ismini almıştır.
PERİYODİK SİSTEMİN TARİHÇESİ
JOHANN DÖBEREİNER
Bu konuyla ilgili ilk çalışmayı 1829 yılında Johann Döbereiner, benzer özellik gösteren elementlerden üçlü gruplar oluşturarak gerçekleştirmiştir.
Döbereiner, elementleri Li-Na-K, Cl-Br-I, Ca-Sr-Ba gibi gruplara ayırmıştır.
Alexandre Beguyer de Chancourtois
Elementlerin artan atom ağırlıklarına göre sarmal bir şekilde sıralamıştır. Benzer özellik gösteren elementler dikey sıralarda alt alta olacak şekilde sıralanmıştır.
Fakat bu listede elementlerin dışında bazı iyonlara ve bileşiklere de yer vermiştir.
John Newlands
O devirde bilinen 62 elementi artan atom ağırlıklarına göre sıralamış, ilk 8 elementten sonra benzer fiziksel ve kimyasal özelliklerin tekrar ettiğini fark etmiştir. Elementleri 8’erli gruplamış ve müzikteki notalara benzetmiştir.
Lothar Meyer–Dimitri İvanovic Mendeleyev
Meyer elementleri benzer fiziksel özelliklerine(değerliklerine göre) göre sıralamıştır.
Mendeleyev bu sıralamayı artan atom ağırlıklarına göre yapmıştır. Mendeleyev oluşturduğu sıralamada elementlerin düzenli olarak (her 8 elementte bir) aynı özellikleri gösterdiğini farketmiştir. Bu sıralama günümüzde kullanılan elementlerin sınıflandırılmasına yakın bir sıralamadır. Bundan dolayı periyodik cetvelin babası kabul edilir.
Henry Moseley
Henry elementlerin sıralamasını artan proton sayısına(atom numarası) göre yapmıştır.
Deneysel olarak atom numaralarını ispatlamıştır.
GLENN SEABORG
Periyodik tabloda en altta bulunan iki sırayı ekleyerek tabloya son halini vermiştir.
PERİYODİK SİSTEMİN ÖZELLİKLERİ
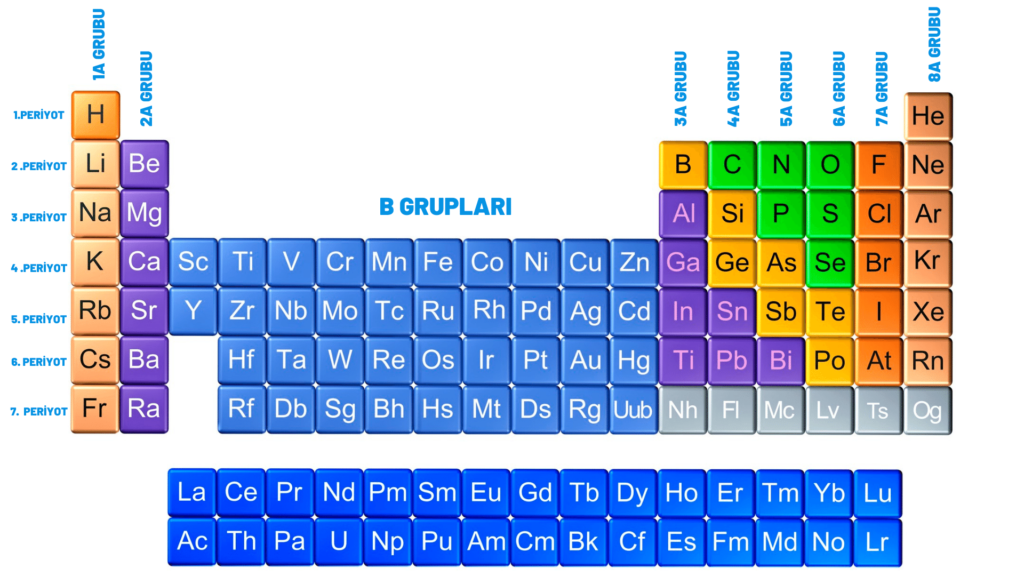
PERİYOT: Artan atom numaralarına göre yan yana sıralanan elementlerden oluşan yatay sıralara (satır)periyot denir.
GRUP: Benzer özellik gösteren elementlerin alt alta gelerek oluşturduğu dikey sıralara(sütun) grup denir.
NOT: Periyodik tabloda bilinen 118 element vardır. 8 adet A grubu ve 10 adet B grubu olmak üzere toplam 18 grup bulunur. Periyodik tablo 7 periyottan oluşur.
PERİYOTLARIN GENEL ÖZELLİKLERİ
- Aynı periyottaki elementlerin katman sayıları aynıdır.
- Aynı periyotta bulunan elementlerin fiziksel özellikleri benzerlik gösterir.
- Aynı periyotta bulunan elementlerin atom numaraları (proton sayıları) soldan sağa doğru artar.
GRUPLARIN GENEL ÖZELLİKLERİ
- Aynı gruptaki elementlerin katman sayıları farklıdır.
- Hidrojen hariç aynı gruptaki elementlerin kimyasal özellikleri benzerlik gösterir.
- Aynı gruptaki elementlerin atom numaraları(proton sayıları) yukarıdan aşağı doğru artar.
Bazı grupların özel adları;
- 1A GRUBU: ALKALİ METALLER
- 2A GRUBU: TOPRAK ALKALİ METALLER
- 7A GRUBU: HALOJENLER
- 8A GRUBU: SOYGAZLAR(ASAL GAZLAR)
ELEMENTLERİN SINIFLANDIRILMASI
1-METALLER
2-AMETALLER
3-YARI METALLER
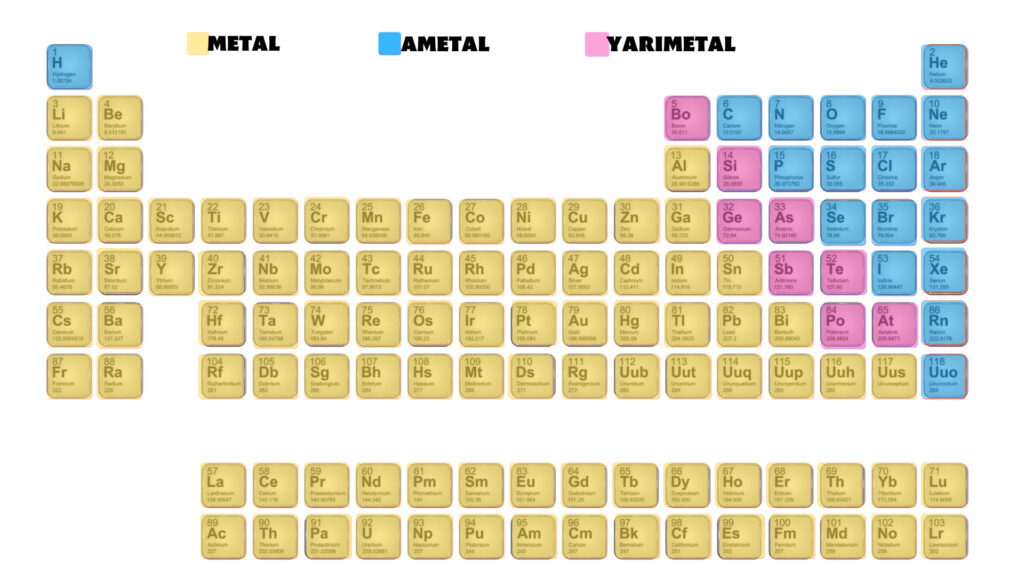
1-METALLERİN ÖZELLİKLERİ
- Yüzeyleri parlaktır, ışığı yansıtır.
- Oda sıcaklığında cıva hariç tamamı katı halde bulunur.
- Tel ve levha haline getirilebilir, işlenebilirler.
- Isı ve elektriği iyi iletirler.
- Kendi aralarında bileşik yapmazlar, alaşım yaparlar.
- Periyodik sistemin sol ve orta kısmında yer alırlar.
- Son katmanlarında 1,2,3 elektron bulunur.
2-AMETALLERİN ÖZELLİKLERİ
- Yüzeyleri mattır, ışığı iyi yansıtmaz.
- Oda sıcaklığında katı, sıvı ve gaz halde bulunabilirler.
- Kırılgandırlar, işlenemez, tel levha haline getirilemezler.
- Isı ve elektriği iyi iletmezler.
- Kendi aralarında ve metallerle bileşik yaparlar.
- Periyodik tabloda sağ tarafta bulunurlar.( H hariç)
- Son katmanlarında 5,6,7 elektron bulunur.
SOYGAZLARIN ÖZELLİKLERİ
- Parlak değil mattır.
- Oda sıcaklığında gaz halde bulunurlar.
- Normal koşullarda bağ yapmaz, bileşik oluşturmazlar.
- Isı ve elektriği iyi iletmezler.
- Tel ve levha haline getirilemezler.
- Tüp içine doldurulup elektrik akımı verilirse her gaz kendine özgü ışık verir.
3-YARI METALLERİN ÖZELLİKLERİ
- Parlak veya mat olabilir.
- Oda sıcaklığında tamamı katı haldedir.
- Tel ve levha haline getirilebilir, işlenebilirler.
- Isı ve elektriği metallerden az, ametallerden fazla iletirler.
- Hem metallerle hem ametallerle bileşik yaparlar.
- Periyodik sistemde metallerle ametaller arasında yer alırlar.
PERİYODİK TABLODA SOLDAN SAĞA DOĞRU;
- Grup numarası artar.
- Atom numarası artar.
- Proton sayısı artar.
- Son katmandaki elektron sayısı artar.
- Katman sayısı değişmez.
- Atom çapı azalır.***
- Periyot numarası değişmez.
- Metalik özellik azalır ametalik özellik artar.
PERİYODİK TABLODA YUKARIDAN AŞAĞI DOĞRU;
- Grup numarası değişmez.
- Atom numarası artar.
- Proton sayısı artar.
- Son katmandaki elektron sayısı değişmez.
- Katman sayısı artar.
- Atom çapı artar.***
- Periyot numarası artar.
- Metalik özellik artar, ametalik özellik azalır.
***Katman sayısının artması atom çapını artırır. Katman sayısı değişmeden proton sayısı artarsa atom çapı küçülür. Bunun nedeni protonların katmanlardaki elektronlara çekim uygulamasıdır. Proton sayısı artarsa bu çekim artar ve elektronları merkeze daha yakın yörüngede dönmeye zorlar. Bu da atom çapını küçültür.
8.Sınıf 4.Ünite Periyodik Sistem Konu Özeti
Fenozom’u Takip Edin!